Indikasjon (godkjent bruk): I 2019 godkjente FDA det for behandling av ervervet, generalisert hypoaktiv seksuell lystforstyrrelse (HSDD) hos kvinner før overgangsalderen når tilstanden forårsaker markert ubehag og ikke skyldes andre medisinske/psykiatriske tilstander eller bivirkninger av legemidler.
Virkningsmekanisme
PT-141 er en melanokortinreseptoragonist (primært MC4-reseptor) som modulerer seksuell lyst gjennom sentralnervesystemets baner.
I motsetning til PDE5-hemmere (f.eks. sildenafil), som hovedsakelig påvirker blodårene, virker PT-141 sentralt for å påvirke seksuell motivasjon og opphisselse.
Farmakologi og dosering
Administrasjon: Subkutan injeksjon, etter behov (ved behov).
Godkjent dose: 1,75 mg subkutant
Farmakokinetikk:
Tmax ≈ ~60 minutter
t½ ≈ 2–3 timer
Effektene kan vare i flere timer, i noen rapporter opptil ~16 timer.
Klinisk effekt (fase III-studier – RECONNECT, 24 uker, RCT-er)
Primære endepunkter:
Indeks for kvinnelig seksuell funksjon – begjærsdomene (FSFI-D)
Skala for seksuell nød hos kvinner (FSDS-DAO)
Viktige resultater (samlede studier 301 + 302):
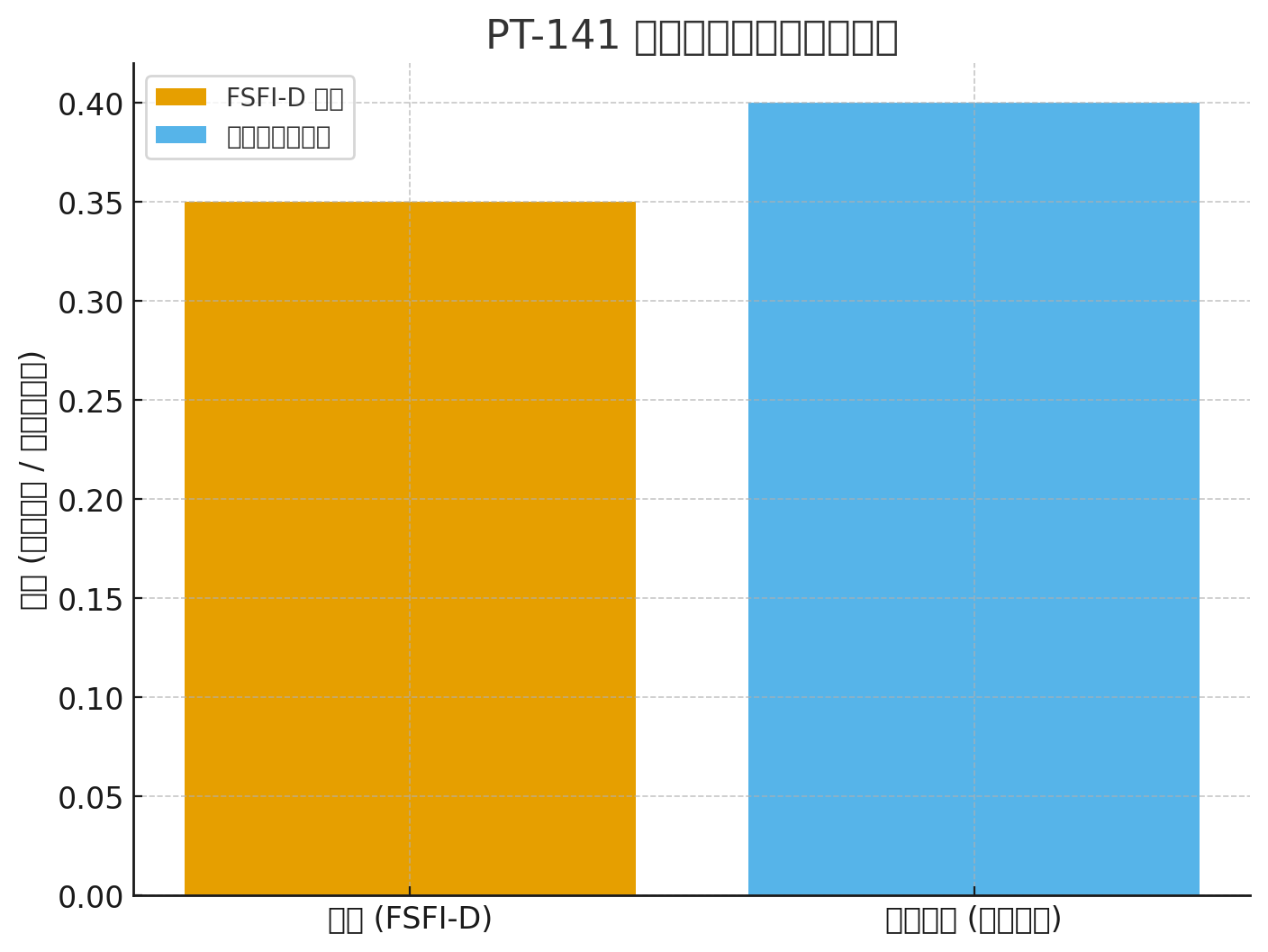
FSFI-D-forbedring: +0,35 vs. placebo (P < 0,001)
FSDS-DAO-skårereduksjon: −0,33 vs. placebo (P < 0,001)
Andre endepunkter: Støttende utfall (score for seksuell funksjon, pasientrapportert tilfredshet) viste en positiv trend, men tilfredsstillende seksuelle hendelser (SSE-er) viste ikke alltid konsistente signifikante forskjeller.
Bivirkninger (oftest rapportert i studier)
Vanlige (≥10 %):
Kvalme (~30–40 %; opptil ~40 % rapportert i studier)
Rødming (≥10 %)
Hodepine (≥10 %)
Kardiovaskulære effekter:
Forbigående økninger i blodtrykk og endringer i hjertefrekvens ble observert, vanligvis forsvunnet i løpet av få timer.
Kontraindisert eller brukes med forsiktighet hos pasienter med ukontrollert hypertensjon eller hjerte- og karsykdommer.
Lever: Sjeldne rapporter om forbigående forhøyede leverenzymer; ekstremt sjeldne kasusrapporter tyder på mulig akutt leverskade, men ikke vanlig.
Langsiktig sikkerhet (utvidelsesstudie)
En 52-ukers åpen forlengelsesstudie fant vedvarende forbedringer i lyst uten nye større sikkerhetssignaler.
Langsiktig sikkerhetsprofil anses generelt som godt tolerert, med de viktigste toleranseproblemene fortsatt kortsiktige bivirkninger som kvalme.
Viktige bruksnotater
Godkjent populasjon er begrenset: Kun for premenopausale kvinner med ervervet, generalisert HSDD.
Ikke bredt godkjent for menn (ED eller lavt lyster hos menn er fortsatt under utprøving).
Sikkerhetsscreening er kritisk: Hypertensjon, hjerte- og karsykdommer og leversykdom bør vurderes før forskrivning.
Hurtig datasammendrag
FDA-godkjenning: 2019 (Vyleesi).
Dose: 1,75 mg subkutan injeksjon, etter behov.
PK: Tmax ~60 min; t½ 2–3 t; effekter opptil ~16 t.
Effekt (fase III, samlet):
FSFI-D: +0,35 (P<0,001)
FSDS-DAO: −0,33 (P < 0,001)
Bivirkninger:
Kvalme: opptil ~40 %
Spyling: ≥10 %
Hodepine: ≥10 %
Forbigående blodtrykksøkninger observert.
Sammenlignende tabell og graf (sammendrag)
| Studie/datatype | Endepunkt / Måling | Verdi / Beskrivelse |
|---|---|---|
| Fase III (301+302 samlet) | FSFI-D (ønskedomene) | +0,35 vs. placebo (P < 0,001); FSDS-DAO −0,33 |
| Bivirkninger | Kvalme, rødme, hodepine | Kvalme ~30–40 % (maks ~40 %); rødme ≥10 %; hodepine ≥10 % |
Publisert: 30. september 2025